Linha do Tempo
Modelos Atômicos
-
Modelo Atômico de Dalton: Bola de Bilhar
No ano de 1808 o inglês John Dalton (1766-1844) lançou a teoria de que o átomo era uma esfera maciça, indivisível e indestrutível. O seu modelo era parecido com uma bola de bilhar. Para ele os átomos de elementos diferentes se distinguiam uns dos outros pelas propriedades, massa e tamanho. Cada elemento químico é formado por átomos iguais. O princípio dizia “toda matéria é formada por átomos, que são partículas minúsculas, maciças, esféricas e indivisíveis.”

-
Modelo atômico de Thomson: Pudim de Passas
Aproximadamente em 1898, Joseph John Thomson (1856-1940) fez experimentos com uma ampola de Crookes, um tubo de vidro fechado. Dentro dessa ampola continha um polo de corrente elétrica positiva e um negativo, gases foram submetidos a altas voltagens e baixas pressões. Sob grande tensão elétrica produziram uma emissão de luz chamada de “raios catódicos”. Com esse experimento ele descobriu que a matéria era composta por partículas negativas e de massa desprezível, os elétrons. Os raios eram produzidos pelo contato entre elétrons e o vidro do tubo. A partir disso criou-se a ideia de que o átomo era uma esfera de carga positiva com cargas negativas espalhadas por ela. Essa teoria ficou conhecida como pudim de passas. Ela diz que “o átomo é constituído por uma partícula esférica de carga positiva, não maciça, divisível e incrustada de elétrons, de modo que sua carga elétrica total é nula”.

-
Modelo atômico de Rutherford: Sistema Planetário
Rutherford (1871-1937), realizou experimentos muito importantes para a química. Partículas alfa com carga positiva de uma amostra de polônio foram jogadas em uma fina lâmina de ouro que ficava dentro de um bloco de chumbo com um orifício que permitia a passagem das partículas. A maior parte delas atravessava a lâmina sem desvios, o que fez com que Rutherford chegasse a conclusão de que o átomo possui imensos espaços vazios. Um pequeno número atravessava sofrendo desvio na trajetória, o que significava que no centro do átomo encontra-se um núcleo pequeno e denso. E ainda menos partículas eram refletidas, encontravam uma barreira, evidenciando que os elétrons giram ao redor do núcleo. Segundo Rutherford o átomo é constituído pela região central, o núcleo, e pela região periférica, a eletrosfera. Ele também sugeriu que para cada carga negativa na eletrosfera, existe uma positiva no núcleo. As cargas positivas foram chamadas de prótons, que possuem aproximadamente 1840 vezes mais massa que os elétrons.
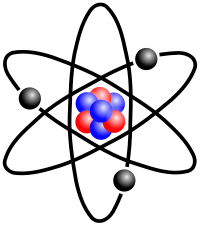
-
Modelo atômico de Bohr
Em 1913 o dinamarquês Niels Bohr (1885-1962), propôs um modelo em que os elétrons circulam por orbitas de acordo com a sua quantidade de energia. Se entendeu que a eletrosfera do átomo era dividida em regiões, as camadas ou níveis. Existem sete camadas onde os elétrons são separados, que são representadas por K, L, M, N, O, P e Q. A energia das camadas é maior a medida de quanto são afastadas do núcleo. Para que um elétron passe de um nível ou camada para outra mais distante precisa receber energia e para retornar perder energia. Em 1934, no contexto de que cargas de sinais iguais se repelem, o cientista James Chadwick propôs a existência de uma nova partícula, o nêutron, que como os prótons ficava no núcleo do átomo, não possui carga elétrica e apresenta a massa muito próxima a do próton.
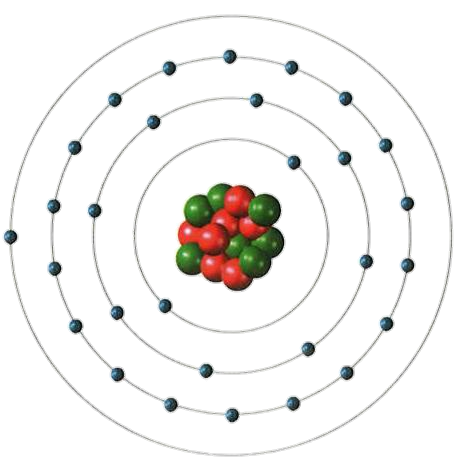
-
Materiais Consultados
https://codepen.io/Naasa21/pen/qdxKMo
https://tableless.com.br/o-que-html-basico/
http://www.cultura.ufpa.br/dicas/
http://cssshark.wordpress.com/2012/10/10/exercicio-massa-atomica/
http://ro-quimica.blogspot.com/2014/01/a-quimica-dos-fogos-de-artificios-para.html?m=1
https://www.soq.com.br/conteudos/em/modelosatomicos/
http://espetacularquimica.blogspot.com/2013/02/modelo-atomicos.html
http://proyectofisica3.blogspot.com/2011/11/potencial-electrico.html
https://nl.dreamstime.com/stock-foto-atoom-model-image11965970
https://descomplica.com.br/blog/quimica/resumo-evolucao-dos-modelos-atomicos/
-
Dados do Trabalho
Integrantes do Grupo:
Cecília Michele Pereira de Brito - 14042003cisa@gmail.com
Eduarda Luísa Engelke - dudaluisa2003@gmail.com
Giane Torres da Cunha - giane.dacunha15@gmail.com
Kauana Maria Gonçalves Selvino - kauanamaria277@gmail.com
Laura Mariana da Silva - lucianes114@gmail.com
Orientadores:
Profº Dr. Bruna Goldani
Profº Me. Frederico Schardong
Instituição:
Instituto Federal - Campus Rolante
Rodovia RS-239, Km 68, Nº 3505 (Estrada Taquara/Rolante)
CEP: 95690-000 | Rolante/RS
